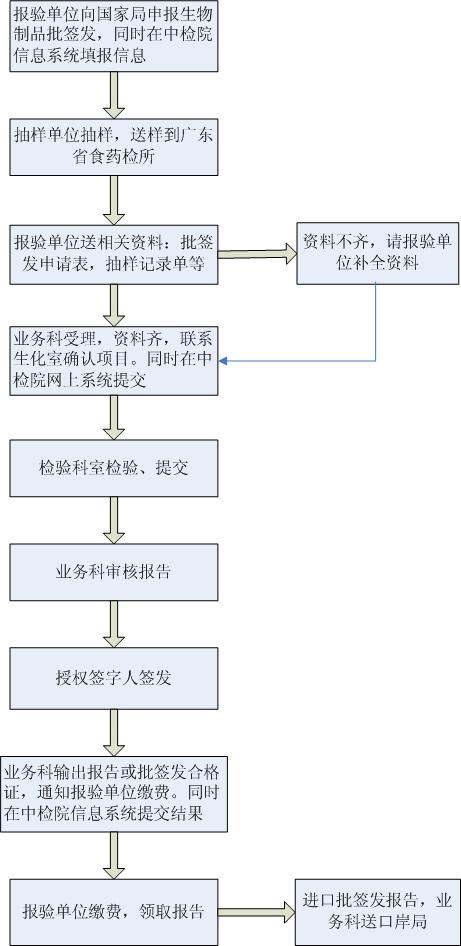
生物制品批签发检验指南
根据《生物制品批签发管理办法》(国家市场监督管理总局令第33号)及我所内部文件《GDIDC-WI-05-P4.4-1生物制品批签发合同评审工作指南》,我所将竭诚为您做好生物制品批签发检验的服务工作,为了更好的为您服务,请在您办理生物制品批签发检验前,仔细阅读以下须知:
一、提供的材料
1.《生物制品批签发现场抽样记录表》(原件一份);
2.中国食品药品检定研究院生物制品批签发管理系统输出的《生物制品批签发申请表》,加盖报验方公章;
3.批生产及检定记录摘要(含生产企业证明),需有授权签发人签字并加盖生产或经销企业公章;
4.血浆质量证书和/或原料血浆中心摘要;
5.关键质量指标趋势分析情况(关键质量指标的的趋势分析情况:包括蛋白质含量、纯度、多聚体含量和铝残留量四个检测项的趋势分析);并按季度年度提供每季度及年度的关键质量指标趋势分析;
6.包装、贴签及说明书;
7.进口疫苗类制品和血液制品应当同时提交进口药品报关的全套资料,包括以下资料:
7.1进口药品抽样记录单
7.2进口药品口岸检验通知书
7.3进口药品通关单
7.4药品批准证明性文件(注明进口药品注册证号及进口药品注册标准的进口药品注册证/药品注册批件)
7.5原产地证明(包括原件及经公证的中文译本)
7.6批签发证明性文件(包括原件及经公证的中文译本)
7.7批签发免签证明性文件(免批签发的药品生产企业提供)
7.8生产商合法生产的证明性文件
7.9经销商合法经营的证明性文件(药品经营许可证、营业执照)
7.10上市后变更的批准证明性文件(提供相关内容的药品注册批件)
7.11签发人等关键人员的签字备案,包括药品生产企业签发人及经销商签字人,如有变动请提供变动情况的说明
7.12交易合同
7.13发货单
7.14打包单
7.15空运单/海运单
7.16以往在国内签发的产品“生物制品批签发证明”(第一次进口法定检验不需提供)
7.17以往在国内批签发机构检验的产品检验报告
二、样品的要求
1.批签发申请的同批样品,样品量一般为正常检验的三倍量,视具体品种而定,具体抽样量见:下载专区-生物制品-《关于发布疫苗类和血液类生物制品批签发抽样量的通知》(中检生检函[2018]187号)。
2.报验方须保证运输过程储存条件符合质量标准的要求,不符合要求的样品我所不予受理。
三、检验项目
1.批签发采取资料审查和样品检验相结合的方式。样品检验分为全部项目检验和部分项目检验。
2.根据资料审查和样品检验的需要,我所会以电话及传真等方式进行沟通,或派员到申报企业进行现场核实或者抽样。
四、检验时限
如无特殊情况,疫苗类制品应当在20个工作日内完成;血液制品类制品应当在35个工作日内完成。
五、其他
1.生产企业对生物制品批签发不合格通知书持有异议的,可以自收到通知之日起7日内,向我所或者中国食品药品检定研究院提出复审的申请。
有下列情形之一的,不予复审:
1.1不合格项目为无菌、热原(细菌内毒素)等食品药品监督管理部门规定不得复验的项目;
1.2样品明显不均匀的;
1.3样品有效期不能满足检验需求的;
1.4批签发申请人书面承诺放弃复验的。
2.按照批签发管理的生物制品进口时,其批签发申请按《药品进口管理办法》规定办理。请参照《进口药品检验报验指南》。
技术部门:广东省药品检验所生物制品室
电话:020-81887684
传真:020-81848209
受理部门:广东省药品检验所业务受理处
办公时间:周一至周五上午8:30~12:00,下午13:00~16:30(逢周五下午14:00~16:30整理资料,不对外办公)。
电话:020-81887683
邮箱:ywjsglk@gdidc.org.cn
地址:广州市黄埔区神舟路766号
投诉电话:020-81865300(质量管理科),020-81853847(人事科)
如有特别业务要求,欢迎您与我所业务受理部门联系。