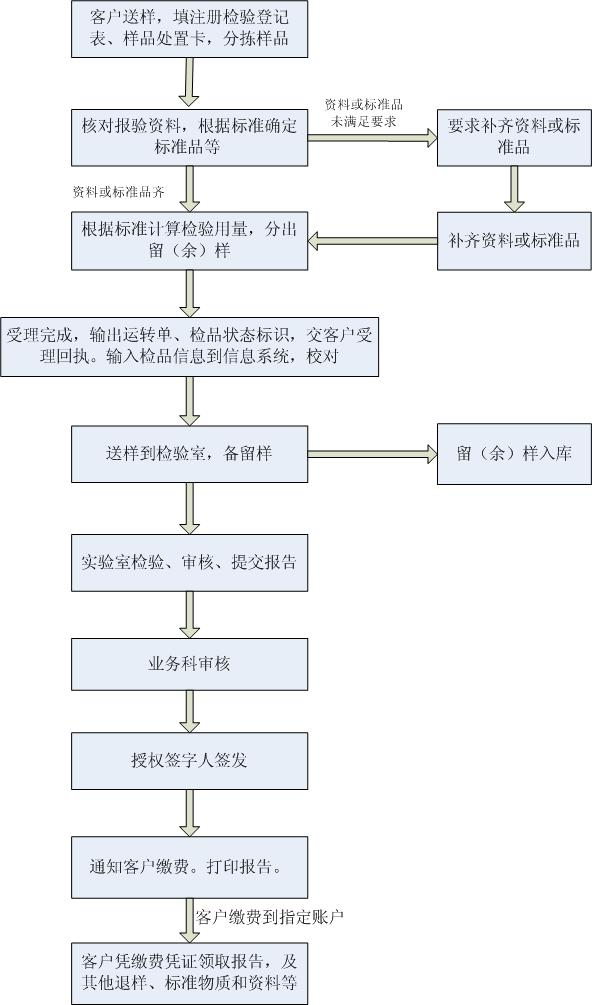
药品注册检验指南
为了您报验工作的顺利进行,前来办理药品注册检验事务的人员应具备相应的专业技术知识,并熟悉药品注册管理法律、法规及其技术要求。根据《药品注册管理办法》(国家市场监督管理总局令第27号)及《药品注册检验工作程序和技术要求规范(试行)》(2020年版),我所将竭诚为您做好注册检验的服务工作,为了更好的为您服务,请在您办理注册检验前,仔细阅读以下须知:
一、提供的资料
1.药品注册检验申请表(一式两份);
2.抽样记录凭证(境内生产药品);
3.进口通关凭证、境外生产药品注册检验任务件(境外生产药品);
4.注册检验通知单原件或补充资料通知(前置注册检验除外);
5.申报品种的药品标准、检验方法及相关检验方法的方法学验证资料(包括无菌及微生物限度检查的验证资料);
6.标准物质说明书;辅料的检验报告书及相关研究资料;若提供非国家药品标准物质(即非中检院标准物质),需提供中检院出具的《药品标准物质原料备案证明》复印件;
7.按照现行版《中国药典》格式整理的药品标准及起草说明,并加盖申报单位或代理公司骑缝章。药品补充申请需同时提交现行的进口药品注册标准;
8.稳定性试验资料;
9.申报制剂所使用的原料药和辅料尚未取得国家药品监督管理局批准的,应当报送有关原、辅料的药品标准和检验方法等资料;
10.其他必要的药学相关资料;主要包括综述资料,药学研究资料,药理毒理研究资料,临床试验资料,非国家标准物质研究资料等;
11.若有增加或修改薄层色谱检查项目的,应提供相应薄层色谱彩色照片;若有提供阴性(空白)辅料的,应提供阴性(空白)辅料制法一份;
12.药品通用技术文件(CTD)资料:模块2(概要)中2.3(质量总体概述);模块3(药学研究资料);
13.原料药随制剂同时申请上市许可的,应同时提供原料药和制剂的资料 ;
其中1-7条为必备资料,化学类药品注册检验还需提供12-13条,根据申报的品种要求提供8-11条几项或全部。以上资料需同时提供纸质版(加盖申请人公章)和相应电子版,境外生产药品应同时提供中、英文版的资料。
为确保申报资料与药品注册申报资料的相应内容一致,请一次性提交完整的申报资料,检验过程中更换任何资料将影响您的样品检验进程。如缺乏相应资料及标准物质,请您根据《药品注册检验补充资料通知书》及时补充有关资料及标准物质。
二、样品的要求
1.样品应该为商业化规模生产的,样品相关信息(如产地、直接接触药品的包装材料等)应与申请上市许可时提供的信息一致。
2.样品应包装完整,有完整标签,境内药品标签内容应符合国家药品监督管理局药品标签说明书相关文件规定,无正规标签的样品,必需贴有临时标签;标签内容至少包括:检品名称、批号、规格、生产单位;已确定效期的样品标签上应注明效期,有特殊储存条件要求的,标签上需注明储存条件。境外已上市的制剂应为完整市售包装。抽样样品应封签完整无损,签名或盖章清晰可辨。样品标签内容必须与资料相应内容一致。
3.样品为多种规格的,每个规格为三批样品,每批样品量为全检量的3倍,样品的有效期应距有效期末一般不少于2个药品注册检验周期,如同时进行样品检验和标准复核的,应当不少于180个工作日;如仅进行样品检验的,应当不少于120个工作日。液体制剂、半固体制剂(如软膏、乳膏等)如处方相同,存在有多种规格的,可根据具体情况确定一种规格的三批样品和其他规格至少一批样品进行检验。
4.原料药应提前在适当的条件下选用与申报包装材料一致的包装材料进行分装后送样,应尽量选取小的分装规格,避免样品污染,保证各项实验的进行
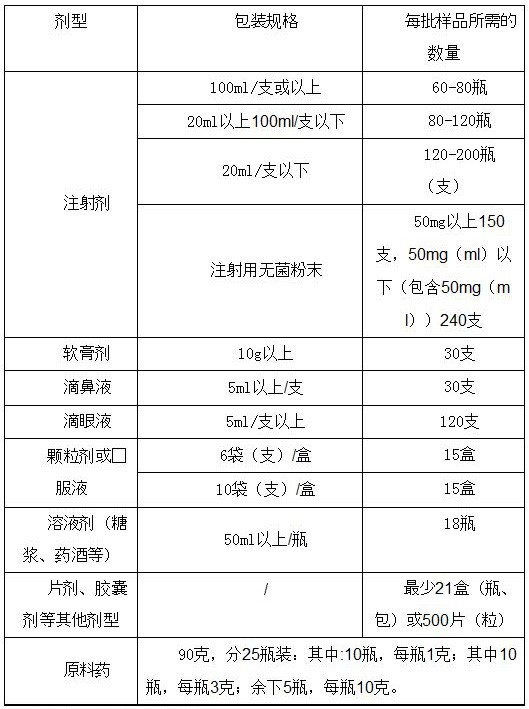
5.标准中涉及微生物限度、无菌等项目的,为避免样品污染,还应提供用于该检验的独立包装样品。需做微生物限度检查项目的品种,请确保该项目有至少两个完整包装的样品(每批样品量应为30~90g(ml)),该项目的剩余样品不计入其余项目的检验用量中。详见表1中各种剂型类别推荐抽(送)样量。
表1:各种剂型类别推荐抽(送)样三倍量(不含微生物无菌)
微生物三倍送样量:如需做沙门菌,90g以上6个包装;不需做沙门菌,30g以上6个包装;
无菌三倍送样量:50mg以下固体,180瓶;50mg以上固体,90瓶;1ml以下液体,180瓶;1-100ml液体,90瓶;100ml以上液体,45瓶。
三、标准物质
提供检验及方法学验证所涉及的标准物质(对照品或标准品),为满足注册检验的3倍量。若为化学药品注册检验,标准物质剩余有效期的要求与样品一致。
四、特殊实验用品
应提供超出现行版《中国药典》标准中使用和其他不易获得的特殊实验材料,包括检验所需使用的特殊色谱柱,特殊试剂等,并提供必要的使用说明文件。
五、检验时限
1.资料和样品接收审核5个工作日。样品检验60个工作日,样品检验和标准复核90个工作日。药品注册检验过程中补充资料时限30个工作日。注册检验时限计时起点为药品检验机构完成接收审核并出具《药品注册检验接收通知书》的日期,计时终点为药品检验机构签发最终药品注册检验报告的日期。
2.药品注册检验过程中,申请人补充检验相关资料和特殊实验材料等、及与药品检验机构沟通所耗时间,以及调查取证、有因抽样检验中与药品审评中心商定检验方案所耗时间不计入注册检验时限。申请人提出异议、专家论证和留样检验的时间不计入注册检验时限。
3.因品种特殊及检验工作中的特殊情况,需要延长检验时限的,经相关负责人批准后,将发送延期通知书告知申请人,延长时限不超过原时限的1/2。如因申请人补充检验相关资料,提供特殊实验材料等不能继续开展注册检验的,经与申请人沟通后暂停注册检验,并在2个工作日内向申请人发出《药品注册检验补充资料通知书》,按要求补充完整后重启注册检验,逾期仍未补充完成的,视为注册检验终止。
4.医院制剂注册检验为40个工作日
5.对于纳入突破性治疗药物程序、附条件批准程序、优先审评审批程序和特别审批程序的药品注册检验,将优先调配检验资源,优先开展并加快完成注册检验。
6.药品审评中心根据审评进展情况,决定不再需要继续进行药品注册检验的,出具终止注册检验通知,将终止注册检验。
7.港澳已上市传统外用中成药注册检验为60个工作日(仅样品检验30日)。
六、检验收费
按照有关规定,不收检验费。
七、其他
1.申请人对注册检验报告有不同意见的,可在收到注册检验报告的7个工作日内向我所提出异议。我所在20个工作日内,组织专家对异议进行论证,给出处理结论。必要时进行留样检验,时间不计入20个工作日。
2.检验过程中若因申报标准问题或其他原因而耽误检验的,我所会及时与您联系,逾期未作答复的,将视作自行放弃处理。
受理部门:广东省药品检验所业务受理处
办公时间:周一至周五上午8:30~12:00,下午13:00~16:30(逢周五下午14:00~16:30整理资料,不对外办公)。
电话:020-81887683
邮箱:ywjsglk@gdidc.org.cn
地址:广州市黄埔区神舟路766号
投诉电话:020-81865300(质量管理科),020-81853847(人事科)
如有特别业务要求,欢迎您与我们业务受理部门联系!